新たな治療法を求めて
~血液透析療法に一石を~
現在の血液透析療法では、低分子の水溶性の毒素の除去が可能です。しかし、ビリルビンのような高分子の毒素は、血液中の主要なタンパク質であるアルブミンに結合するためその除去は困難です。このようなアルブミンに対して高い結合性がある毒素は、アルブミン結合毒素(ABT)と呼ばれます。新たな透析療法として、透析液にアルブミンを循環させ結合毒素を引き抜くアルブミン循環透析法(ECAD)が注目されてきています。しかし現状では、アルブミンによる引き抜き効果が充分に得られず、毒素の除去が不十分という問題があります。まだまだ臨床効果が低く問題が多いこの透析法を、より効率的なものに改良することが望まれています。
わたしたちのグループでは、ファージディスプレイ法という方法を用いて、アルブミン結合毒素(ABT)に対してより高い親和性を示す、機能性ヒト血清アルブミンの開発研究を行っています。ファージディスプレイ法では、アルブミンが薬物と結合する部位を分子表面に提示させることができるため、アルブミン結合毒素(ABT)を効果的に取り除くことができます。医療に役立つ、すぐれた血液透析療法用の素材の開発と機能の評価を行っています。
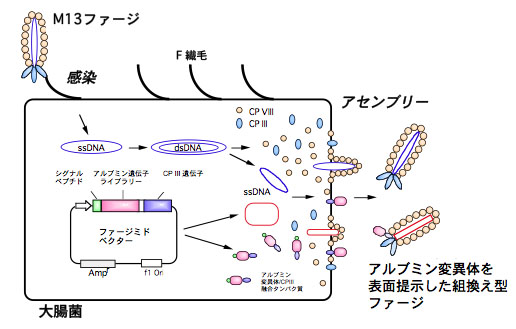
ファージディスプレイ法によるアルブミン変異体の作製








